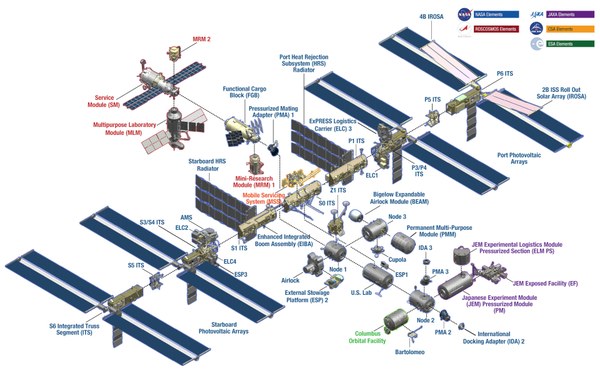
Internationale Raumstation ISS
Die Internationale Raumstation ISS ist ein „fliegendes Labor” im Erdorbit mit exzellenten Möglichkeiten für Grundlagenwissenschaft und anwendungsnahe Forschung. In der Schwerelosigkeit der um die Erde „fallenden” Raumstation gewinnen Wissenschaft und Gesellschaft einzigartige Erkenntnisse aus der Astrophysik über die Materialforschung bis hin zu Psychologie und Medizin. Experimente auf der ISS bereiten darüber hinaus künftige astronautische Langzeitmissionen zur Exploration von Mond oder Mars vor.
Die ISS ist ein Innovationsmotor für neue Industriezweige und Technologien wie zum Beispiel Laserkommunikation, Robotik und Sensorik. Auf der ISS entwickeln die großen Raumfahrtnationen gemeinsam Lösungen für die globalen Herausforderungen unserer Gesellschaft: Gesundheit, Umwelt und Klimawandel sowie Digitalisierung, Industrie 4.0, Energie und Mobilität von morgen.
Forscherinnen und Forscher aus Deutschland sind seit Beginn der wissenschaftlichen Nutzung der Raumstation im Jahr 2001 dabei. Das erste Experiment überhaupt war das deutsch-russische PKE-Experiment zur Erforschung des Wachstums von Plasmakristallen in Schwerelosigkeit. Mit über 100 wissenschaftlichen Veröffentlichungen zählt es zu den erfolgreichsten Forschungsprojekten auf der ISS. Bis heute wurden weit mehr als 3.000 Experimente aus 108 Staaten auf der ISS durchgeführt. Rund 250 Personen aus 19 Ländern der Erde sind seither zur ISS geflogen. Rund 500 Experimente stammen aus den ESA-Nutzungsprogrammen. In rund 200 dieser europäischen Experimente waren deutsche Wissenschaftlerinnen und Wissenschaftler beteiligt.
Für Deutschland als Exportnation, Hochtechnologieland und Wissenschaftsstandort ist die Forschung auf der ISS Investition in die Zukunft und gleichzeitig Inspiration für den Nachwuchs. Astronautische Missionen mit deutscher Beteiligung im Auftrag der Europäischen Weltraumorganisation ESA stärken den Wissenschafts- und Innovationsstandort Deutschland und machen die Bundesrepublik zu einem der intensivsten Nutzer und Profiteure der wissenschaftlichen Anlagen an Bord der ISS, damit aus „Science Fiction“ „Science Facts“ werden.
Nachrichten
Multimedia