Der „Tanz der Teilchen“

chris 論 (vectorisation), Raimund Apfelbach, Public domain, via Wikimedia Commons
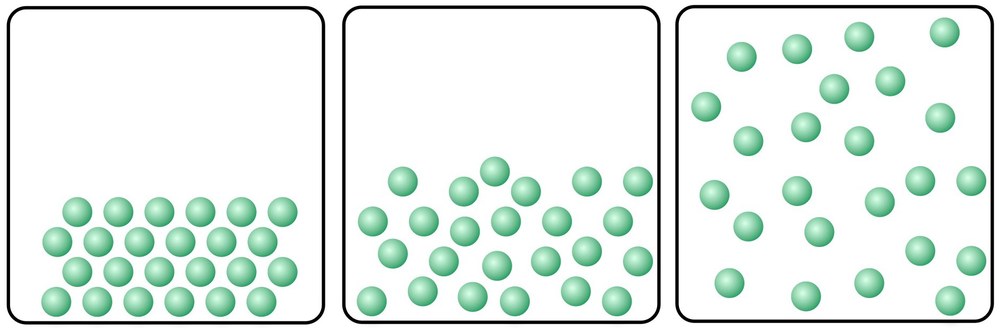
Warum das so ist? Nun, jeder Körper und jeder Stoff – einfach alles auf der Welt – besteht aus kleinen Bausteinen, den Atomen, die sich auch miteinander zu Molekülen verbinden können. Stell dir diese Teilchen einfach mal wie winzig kleine Kügelchen vor. Jetzt kommt es darauf an, wie dicht die Kügelchen angeordnet sind. Wenn etwas fest ist, haben diese Teilchen meist eine Verbindung zu ihren Nachbarn – alle ganz eng beieinander. Wenn ein Stoff flüssig ist, sind die Abstände etwas größer. Und im gasförmigen Zustand sind die Teilchen noch weiter auseinander. Dabei ist folgendes wichtig: Die Teilchen liegen nicht still nebeneinander. Sondern sie schwingen leicht hin und her – es ist ein bisschen so, als ob sie „tanzen“ würden. Natürlich sieht man das einem Stoff nicht an. Aber ganz im Kleinen, in der „Mini-Welt“ der Teilchen, ist alles leicht in Bewegung. Und dabei bewegen sich die Teilchen umso mehr, je höher ihre Temperatur ist. Denn die Wärme, die einem Teilchen beim Erhitzen zugeführt wird, ist nichts anderes als Energie. Und wenn ein Teilchen mehr Energie hat, dann kann es – um bei unserem Beispiel vom „Tanz der Teilchen“ zu bleiben – einfach besser tanzen.
Stell es dir wirklich extrasupermegastark vereinfacht so vor: Die Teilchen in einem kalten Zimmer haben wenig Energie. Sie stehen alle ganz dicht nebeneinander, geben sich die Hände und wippen nur mal beim Tanzen vom einem Fuß auf den anderen. Für mehr Bewegung reicht ihre Energie nicht. Jetzt wird die Heizung aufgedreht und es wird wärmer im Raum. Die Wärme verleiht den Teilchen zusätzliche Energie. Dadurch werden sie munter und fangen an, sich beim Tanzen mehr zu bewegen. Jedes Teilchen schwingt jetzt stärker hin und her, braucht dafür etwas mehr Platz, rempelt die Nachbarn etwas weg – und einige Teilchen lassen auch die „Hände“ ihrer Nachbarn los – wobei ja wohl klar ist, dass diese Teilchen keine Hände haben ;-). Jetzt wird es noch wärmer im Raum: Immer wilder tanzen die Teilchen hin und her, und bei dieser wilden Tanzerei gibt auch niemand mehr einem anderen Teilchen die (nicht vorhandene) Hand. ;-)
Das Beispiel vom Tanz der Teilchen sollte zeigen: Die Wärmeenergie bestimmt, wie schnell ein Teilchen schwingt: Je mehr Wärmeenergie ein Teilchen erhält beziehungsweise ihm zugeführt wird, also je höher die Temperatur ist, desto heftiger schwingt es hin und her. Und wenn jedes der Teilchen sehr schnell schwingt, kann es passieren, dass sich dabei die Verbindungen zu den anderen Teilchen lösen und der Verbund also nach und nach aufbricht. Erst lösen sich nur einige Bindungen – und genau das passiert, wenn ein fester Stoff zu schmelzen beginnt! Ist der Verbund der Teilchen also nur noch wenig erhalten, ist aus einem festen Stoff eine Flüssigkeit geworden. Wird dann dieser Flüssigkeit noch mehr Wärmeenergie zugeführt, können die Teilchen sich noch heftiger und schneller bewegen, bis sich alle Bindungen zu anderen Teilchen lösen – und aus der Flüssigkeit wird dann ein Gas.
Schauen wir uns das Ganze einmal für Wasser an. Ist es sehr kalt, befindet sich Wasser im erstarrten, also festen Zustand. Wird es erwärmt, geschieht erst bei 0 °C etwas. Das ist nämlich der Schmelzpunkt von Wasser. Dort ist die Wärmeenergie so groß, dass sich die Teilchen teilweise voneinander lösen. Wir sehen dann, dass das Wasser flüssig wird. Und flüssig bleibt es auch eine ganze Weile, wenn man es erhitzt: Erst wenn das Wasser eine Temperatur von 100 °C erreicht hat, können sich die Teilchen restlos voneinander lösen. Hier ist also der Siedepunkt erreicht und aus dem flüssigen Wasser wird Wasserdampf.
Wikipedia/Bitjungle
Allgemein können wir also festhalten, dass der Aggregatzustand eines Stoffes abhängig von der Temperatur ist: Ist seine Wärmeenergie niedrig, ist er fest, wird Wärmeenergie hinzugeführt, wird er erst flüssig und dann gasförmig. Das ist allerdings nur die halbe Wahrheit. Denn auch eine zweite Größe spielt eine wichtige Rolle. Und zwar der Druck!
