Angewandte Weltraum-Zellbiologie
Im Forschungsschwerpunkt der Angewandten Weltraum-Zellbiologie untersuchen wir weltraumbedingte Veränderungen zellulärer Mechanismen neuronaler Zellen. Dabei verwenden wir für die menschliche Gesundheit relevante Modellsysteme wie menschliche Zellen und Mauszellen, personalisierte Stammzellen und daraus abgeleitete Organoide. Um weitere Einblicke in zugrundeliegende Mechanismen zu gewinnen und Ansatzpunkte für Gegenmaßnahmen zu identifizieren, wenden wir sowohl reale Mikrogravitation als auch bodengestützte Simulationseinrichtungen von Weltraumbedingungen wie Mikrogravitation, Hypergravitation, ionisierende Strahlung und veränderte atmosphärische Bedingungen an.
Gegenmaßnahmen für neuronale Veränderungen im Weltraum und auf der Erde
Extreme Umweltbedingungen, wie sie im Weltraum vorzufinden sind, können essentielle neuronale Strukturen und Funktionen des menschlichen Gehirns beeinträchtigen. Daher ist die Entwicklung von entsprechenden neuroprotektiven Wirkstoffen für zukünftige bemannte Raumfahrtmissionen von entscheidender Bedeutung. Der Verlust der synaptischen Plastizität im Gehirn zum Beispiel wird direkt mit kognitiven Defiziten in Verbindung gebracht und bietet daher ein vielversprechendes Ziel für eine therapeutische Intervention. Das Neurostimulanz Ketamin wird bereits bei therapieresistenter Depression angewendet, zeigt jedoch neben seiner stimulierenden Wirkung auf das Synapsenwachstum erhebliche psychotrope Nebenwirkungen. Kürzlich wurde seinem Metaboliten, Hydroxynorketamin (HNK), eine ähnliche Wirkung auf die synaptische Plastizität zugeschrieben, dessen schwache Affinität zu NMDA-Glutamatrezeptoren zudem zu einer Milderung der psychotropen Nebenwirkungen führte.
Ziel der Forschung auf diesem Gebiet in Zusammenarbeit mit der Technischen Hochschule Köln ist es, die Wirkung der Neurostimulanz Ketamin auf die synaptische Plastizität für Astronautinnen und Astronauten ebenso wie für Patientinnen und Patienten auf der Erde zu nutzen und zu optimieren.
Vorläufige Ergebnisse, beispielsweise aus mikroskopischen Untersuchungen und elektrophysiologischen Messungen, zeigen, dass potentielle Störungen der synaptischen Plastizität durch die neuen Verbindungen möglicherweise abgemildert werden könnten. Neben einem Einsatz in der Raumfahrt haben die neuartigen Derivate zudem das Potenzial zur Entwicklung einer verbesserten Therapie-Methode gegen neurodegenerative Erkrankungen auf der Erde.
FLUMIAS: Hochauflösendes 3D- Fluoreszenzmikroskop für „Live Cell Imaging“ auf der ISS
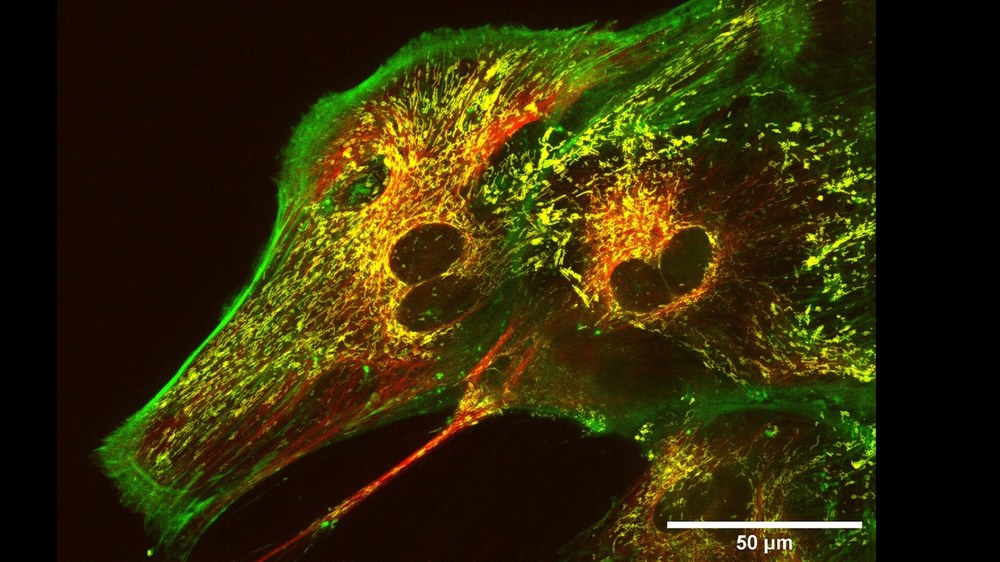
FLUMIAS ist ein Live-Cell-Fluoreszenzmikroskop zur Messung von Veränderungen von Stoffwechselprozessen, Membrandynamiken und Verhalten in lebenden Zellen und Mikroorganismen in Echtzeit. Mit FLUMIAS möchten wir die Auswirkungen veränderter Schwerkraftbedingungen auf mikroskopischer Ebene besser verstehen. Durch die Verwendung von fluoreszierenden Farbstoffen und Markern können Strukturen innerhalb menschlicher und tierischer Zellen sichtbar gemacht werden, um lebende Zellen über längere Zeiträume zu mikroskopieren und als 4D-Modelle zu visualisieren. Das FLUMIAS-Mikroskop wird voraussichtlich 2026 auf einer Zentrifuge auf der ISS installiert, sodass die Proben in Schwerelosigkeit, aber auch unter bis zu 1g, also Erdbeschleunigung, beobachtet werden können. Zusätzlich zur Mikroskopeinheit beinhaltet FLUMIAS ein Lebenserhaltungssystem, welches durch eine Temperatursteuerung und Pumpenanlage die Proben am Leben hält und mit Nährstoffen versorgt.
Das LAARA-Experiment an Bord der ISS
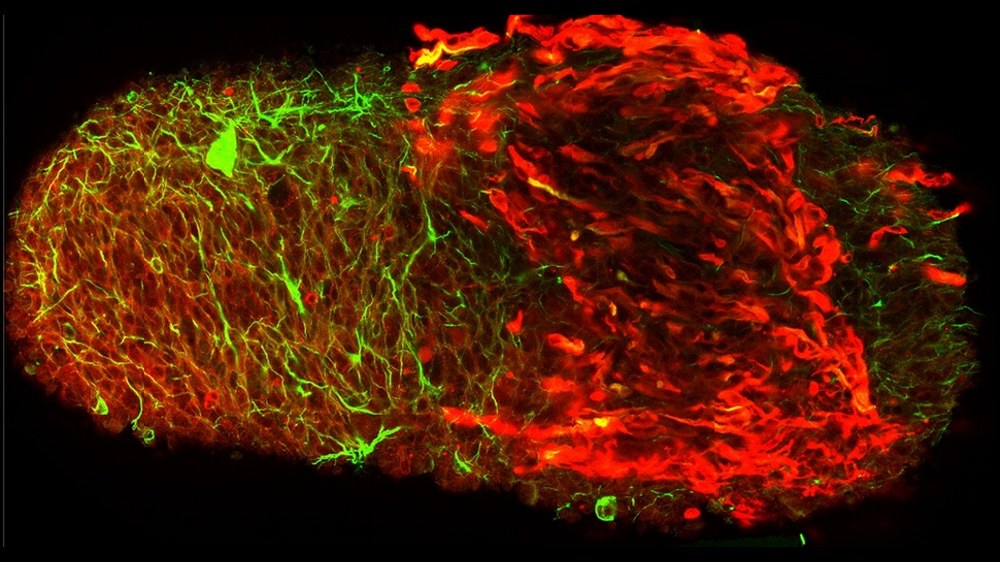
Mit dem LAARA-Experiment wird FLUMIAS ab 2026 an Bord der ISS eingesetzt, um Parameter der Astrozytenreaktivität zu untersuchen. Astrozyten sind der vorherrschende Typ von Gliazellen im Gehirn. Diese Zellen haben zwei Hauptfunktionen: Im gesunden Gewebe unterstützen sie die Neuronen, indem sie Nährstoffe liefern und den extrazellulären Raum von überschüssigen Neurotransmittern und Abfallprodukten befreien. Im Falle einer Verletzung des Gehirns oder des Nervensystems verändern sich Astrozyten im umliegenden Gewebe und werden reaktiv, sie proliferieren und wandern zum Ort der Verletzung, wo sie durch „reaktive Astrogliose“ die Glia-Narbe bilden. Diese hat eine hemmende Wirkung auf die Regeneration des verletzten neuralen Gewebes. Diese angesprochenen Prozesse sind hochdynamisch und unterziehen die neuronalen Zellen weitreichenden morphologischen und daher zytoskelettalen Anpassungen. Wir haben in vorangegangenen Studien herausgefunden, dass diese Veränderungen der Zellen, wie schnell und wie viele Astrozyten reaktiv werden, abhängig sind von der Schwerkraftumgebung. Durch das LAARA-Experiment soll nun herausgefunden werden, ob Schwerelosigkeit negative Auswirkungen auf die Gesundheit des Gehirns von Astronauten haben könnte.
Die mit FLUMIAS mikroskopisch untersuchten Faktoren beinhalten morphologische Merkmale, Migrationsverhalten und die Dynamik von intrazellulären Aktinfasern, dem Mikrotubuli-Netzwerk sowie des mitochondrialen Transports. Astrozyten, die an Mikrogravitation angepasst sind, werden während der Re-Adaptation an verschiedene Gravitationsbedingungen und während einer zweiten Anpassungsphase zurück an Mikrogravitation mikroskopiert, um adaptive Veränderungen des Zytoskeletts zu erforschen. Zusätzlich werden alle Parameter in bodengestützten Verifizierungsstudien mit dem FLUMIAS Science Reference Model und speziellen Inkubator-Zentrifugen untersucht. Die Ergebnisse könnten potenzielle Einflüsse auf die Kognition und motorische Leistung von Astronautinnen und Astronauten aufzeigen und zu therapeutischen Interventionen auch für Patientinnen und Patienten auf der Erde führen.
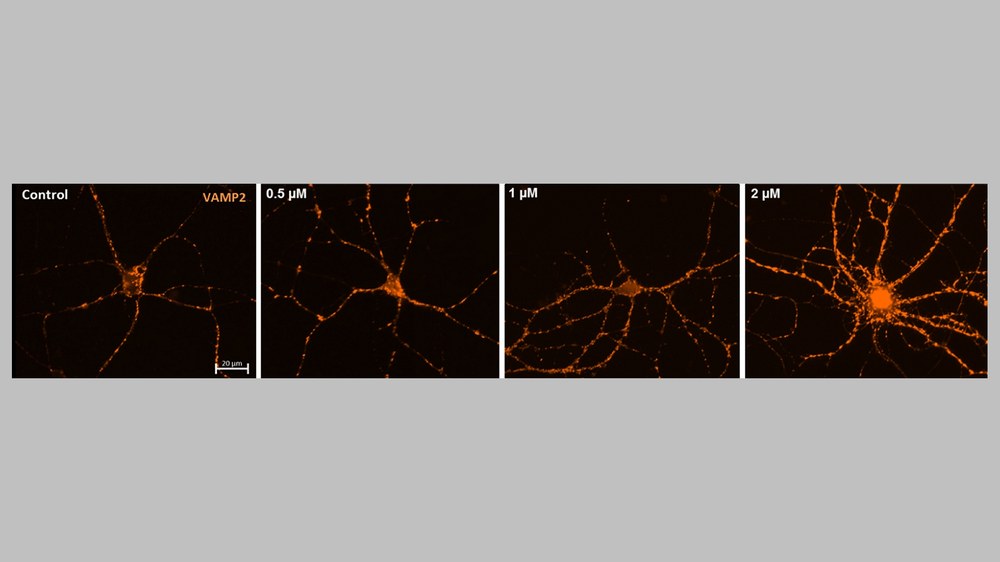
Gravitationsinduzierte Veränderungen in der neuronalen Übertragung mittels humaner neuromuskulärer Organoide
Die Schwerelosigkeit im Weltraum kann zu weitreichenden physiologischen Veränderungen im menschlichen Körper führen, insbesondere zu Muskelatrophie und dem Verlust von Knochenmasse. Trotz intensiver körperlicher Aktivität können Astronautinnen und Astronauten innerhalb von nur zwei Wochen bis zu 20% ihrer Wadenmuskulatur verlieren. Ein wesentlicher, bisher unzureichend verstandener Faktor ist die Rolle neuromuskulärer Verbindungen (NMJs), die die Kommunikation zwischen Motoneuronen und Muskelzellen vermitteln. Veränderungen in der Gravitation beeinflussen unter anderem die Viskosität neuronaler Membranen und können dadurch die neuronale Reizweiterleitung und synaptische Funktion beeinträchtigen. Die direkte Untersuchung menschlicher NMJs im All ist aufgrund eingeschränkter Zugangsmöglichkeiten bisher nicht möglich, weshalb die Forschung stark auf Tiermodelle angewiesen ist. Ein innovativer und zukunftsweisender Ansatz ist daher die Nutzung humaner neuromuskulärer Organoide (NMO), die aus induzierten pluripotenten Stammzellen (iPSCs) generiert werden. Diese ermöglichen die modellhafte Untersuchung der Auswirkungen veränderter Gravitationsbedingungen auf humane NMJs unter kontrollierten Laborbedingungen. Ziel ist es, die Entwicklung dieser komplexen Organoidsysteme weiter zu optimieren, um komplexe Gewebestrukturen zu erzeugen und die Mechanismen von muskeldegenerativen Krankheiten besser zu verstehen, die durch veränderte neuronale Signalübertragung beeinflusst werden.
Im Zentrum unserer Forschung steht das Verständnis der zugrundeliegenden molekularen Mechanismen der zellulären Schwerkraftwahrnehmung in iPSC-abgeleiteten Zelltypen, insbesondere solchen, die an der neuromuskulären Verbindung sowie in zerebralen und retinalen Organoiden beteiligt sind. Eine zentrale, bislang unbeantwortete Frage, die sich bei der Untersuchung der Muskeldekonditionierung stellte, ist der Einfluss der veränderten neuronalen Signalübertragung als Grundlage für die verminderte Muskelaktivität.
Um ein robustes Modellsystem zu etablieren, werden NMOs in 3D-Petri-Schalen kultiviert, die die selbstständige Bildung sphäroider 3D-Mikrogewebe ermöglichen. Diese neuromuskulären Organoide bilden funktionale Miniaturmodelle der Verbindung zwischen Nerven- und Muskelzellen nach und eignen sich ideal zur Erforschung neuromuskulärer Erkrankungen sowie zur Entwicklung neuer Therapieansätze.
Neben der Untersuchung molekularer Mechanismen der Schwerkraftwahrnehmung in Zellen und menschlichen Probandinnen und Probanden liegt ein weiterer Fokus auf der individuellen Reprogrammierung und Kultivierung menschlicher induzierter pluripotenter Stammzellen (iPSCs). Langfristiges Ziel ist es, Multi-Omics-Analysen von personalisierten Zelltypen aus verschiedenen Weltraumstudien durchzuführen.
Weiterführende Links
Kontakt
Dr. rer. nat. Christian Liemersdorf
Dr. rer. nat. Patrick Lau
